Diagrama de temas
-
-
Foro
-
-
-
El ser humano, en su afán por comprender la composición del Universo, tiende a reducir la información que la naturaleza le brinda a conceptos simples. Como ejemplo tenemos las ideas de los filósofos griegos Demócrito, Leucipo y Epicuro sobre el concepto de elementos: unas cuantas sustancias a partir de las cuales forman todas las demás; y de átomos o partículas indivisibles las cuales forman los elementos.
Sin embargo, este concepto no se obtuvo como resultado de la experimentación, sino como una necesidad filosófica que explicara la realidad. Éstos pensadores proponían que la materia no podía dividirse indefinidamente, por lo que debía existir una unidad o bloque indivisible e indestructible que al combinarse de diferentes formas creara todos los cuerpos macroscópicos que nos rodean.

Estas ideas no fueron aceptadas, la influencia de Aristóteles, otro gran pensador griego, hizo que se impusiese la teoría de los cuatro elementos, según la cual la materia era de naturaleza continua y estaba formada por diferentes combinaciones de Tierra, Agua, Aire y Fuego.
Ya en épocas más recientes, con los resultados experimentales de Brown (movimiento browniano), Faraday (electrólisis) , Lavoisier (conservación de la masa) y muchos otros, se consolidó la idea atómica. Ejemplificada en el modelo de Dalton.
Posteriormente con el descubrimiento del electrón, el núcleo y el fotón, se demostró que el átomo tiene una estructura interna. En este periodo se desarrollaron los modelos atómicos de Thompson, Rutherford y Bohr.
La siguiente etapa de la estructura de la materia se refiere a la era de las partículas "nucleares": el protón, el neutrón, el positrón, etc. Todas estas partículas fueron consideradas como los bloques más elementales de la naturaleza hasta que su número fue aumentando y ya no se creyó que fueran las fundamentales.

Finalmente en la actualidad se realizó otra unificación, a través del modelo estandard. En la cual los bloques fundamentales serían los cuarks y leptones.

-
MODELOS ATÓMICOS


Modelo de Dalton
Aún cuando ya personajes de la antigüedad, como Demócrito y Leucipo, habían propuesto la idea de una estructura atómica de la materia, sus afirmaciones no se apoyaban en ningún experimento.
El modelo atómico de Dalton (1776-1844) fue el primer modelo atómico con bases científicas que permitió explicar y unificar las tres leyes que formaban la base de la Química de la época.
Intentando dar una interpretación coherente a este conjunto de hechos, Dalton formuló su modelo a partir de los siguientes postulados:
- La materia está formada por partículas pequeñísimas llamadas “átomos”.
- Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
- Todos los átomos de un mismo elemento químico son iguales entre si y diferentes de los átomos de cualquier otro elemento. Por ejemplo los átomos de oxígeno son iguales entre si, pero diferentes a los de hidrógeno.

- Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo, los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples. Por ejemplo: al formarse agua, la relación es de 2 a 1 (dos átomos de hidrógeno con un átomo de oxígeno)

Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo, un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2)
 La razón de oxígeno en estos dos compuestos es 1:2.
La razón de oxígeno en estos dos compuestos es 1:2.
Limitaciones
Es innegable que el modelo de Dalton fue muy importante para la ciencia. Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radiactividad ni la presencia de los electrones (e-) o protones (p+).Modelo de Thompson
"Modelo del pudin de pasas".Representación de las estructuras de los átomos de los seis primeros elementos, siguiendo el modelo de Thomson.
Experimentos de Thompson
Para descubrir el electrón y proponer el modelo del átomo, Thompson realizó una gran cantidad de experimentos con el tubo de rayos catódicos.Tubo de rayos catódicos El tubo de rayos catódicos fue creado por William Crookesson. Consiste en una corriente de electrones que fluyen en un tubo de vacío, el cual tiene por lo menos dos electrodos; un cátodo (electrodo negativo) y un ánodo (electrodo positivo). Cuando se calienta el cátodo, emite una cierta radiación que viaja hacia el ánodo. Si las paredes internas de vidrio detrás del ánodo se cubren con un material fluorescente, brillan intensamente.
El tubo de rayos catódicos fue creado por William Crookesson. Consiste en una corriente de electrones que fluyen en un tubo de vacío, el cual tiene por lo menos dos electrodos; un cátodo (electrodo negativo) y un ánodo (electrodo positivo). Cuando se calienta el cátodo, emite una cierta radiación que viaja hacia el ánodo. Si las paredes internas de vidrio detrás del ánodo se cubren con un material fluorescente, brillan intensamente.Los que podemos resumir en tres:
- En un primer experimento, investigó si las cargas negativas podrían ser separadas de los rayos catódicos por medio de magnetismo.
- Thomson descubre que los rayos catódicos son desviados magnéticamente, y llega a la conclusión que son partículas cargadas con carga negativa.
Observa que tenemos un campo magnético que entra a la pantalla. En un segundo experimento encontró que los rayos catódicos eran desviados por un campo eléctrico, lo que confirmaba que debían ser partículas cargadas. con carga negativa.
En un segundo experimento encontró que los rayos catódicos eran desviados por un campo eléctrico, lo que confirmaba que debían ser partículas cargadas. con carga negativa. En un tercer experimento, Thompson modifica los campos eléctricos y magnéticos de tal forma que no hay desviación del haz de rayos catódicos.
En un tercer experimento, Thompson modifica los campos eléctricos y magnéticos de tal forma que no hay desviación del haz de rayos catódicos. A los rayos catódicos, que estaban cargados, Thompson les llamó “corpúsculos” dichos corpúsculos se originaban dentro de los átomos de los electrodos. Lo que esto significaba era que los átomos debían ser divisibles. Thomson imaginó que el átomo se compone de estos corpúsculos (electrones) en un mar lleno de carga positiva.
A los rayos catódicos, que estaban cargados, Thompson les llamó “corpúsculos” dichos corpúsculos se originaban dentro de los átomos de los electrodos. Lo que esto significaba era que los átomos debían ser divisibles. Thomson imaginó que el átomo se compone de estos corpúsculos (electrones) en un mar lleno de carga positiva.
Modelo del átomo de Thompson
Modelo de Rutherford
 En
1911 Ernest
Rutherford estableció la existencia del
núcleo atómico a partir de los datos experimentales de la
dispersión de partículas alfa por núcleos de átomos de oro,
obtenidos de su famoso "experimento de la
lámina de oro".
En
1911 Ernest
Rutherford estableció la existencia del
núcleo atómico a partir de los datos experimentales de la
dispersión de partículas alfa por núcleos de átomos de oro,
obtenidos de su famoso "experimento de la
lámina de oro".
Para Rutherford, el átomo era un sistema planetario de electrones (carga negativa) girando alrededor de un núcleo atómico muy pesado y con carga eléctrica positiva.

El modelo atómico de Rutherford puede resumirse de la siguiente manera:
- El átomo posee un núcleo central pequeño, con carga eléctrica positiva, que contiene casi toda la masa del átomo.
- Los electrones giran a grandes distancias alrededor del núcleo en órbitas circulares.
- La suma de las cargas eléctricas negativas de los electrones debe ser igual a la carga positiva del núcleo, ya que el átomo es eléctricamente neutro.
Rutherford calculó el tamaño del átomo, su diámetro sería del orden de 10-10 m mientras que el de su núcleo del orden de 1014 m. Es decir el núcleo es unas diez mil veces menor que el átomo, por lo que es de suponerse una gran cantidad de espacio vacío en la estructura atómica de la materia.
Experimento de la lámina de oro
Antes de que Rutherford postulara su modelo atómico ya se conocía el modelo propuesto por J.J.Thomson de 1904. Este concebía el átomo como una esfera de carga positiva uniforme en la cual están incrustados los electrones.
Para comprobar este modelo, Rutherford junto con sus alumnos Geiger y Mardsen desarrollaron el experimento conocido como " de la lámina de oro". Consistía en bombardear láminas de oro muy delgadas (5 x 10 -8 m) con partículas alfa α ( partículas con carga positiva).

Lo que observó fue:
- La mayor parte de las partículas alfa atravesaban la lámina de oro sin sufrir ninguna desviación
- Muy pocas (una de cada 10.000 aproximadamente) se desviaba un ángulo mayor de 100
- En rarísimas ocasiones (un 0.0005%) las partículas rebotaban en la lámina


Interpretación dada por Rutherford
- Si el modelo atómico propuesto por Thomson fuera cierto no deberían observarse desviaciones ni rebotes de las partículas incidentes, éstas atravesarían los átomos sin desviarse.
-

- Para que las partículas se desvíen, deben encontrar en su trayectoria una zona cuya masa sea comparable o mayor a la de las partículas incidentes, además,debe tener carga positiva. (Lo que ahora llamamos núcleo)
- El tamaño del núcleo debería de ser muy pequeño comparado con el total del átomo.
- La carga eléctrica (negativa) de los electrones debería estar exactamente compensada con la positiva del núcleo, ya que los átomos son eléctricamente neutros.
-
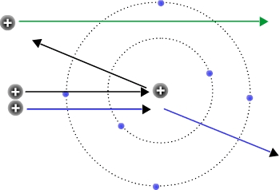

Todo lo anterior se puede explicar si suponemos un modelo planetario de átomo con un núcleo central (muy pequeño en relación con la totalidad del átomo) en el que se concentra la masa y la carga positiva. Los electrones girarían (de forma análoga a como lo hacen los planetas alrededor del Sol) en órbitas concéntricas alrededor del núcleo.

Problemas del modelo de Rutherford del átomo:
- El modelo de Rutherford entraba en contradicción con las ecuaciones de Maxwell, que predecían que una carga eléctrica acelerada debía emitir energía en forma de radiación electromagnética, así que el electrón tendría que acabar estrellado contra el núcleo.

En aquella se época ya se conocían los espectros atómicos de emisión y absorción de los gases a baja presión, los cuales no son continuos como los de los cuerpos calientes. El modelo no explica la discontinuidad de los espectros.


Radiación de cuerpo negro
Todos los objetos emiten ondas electromagnéticas; un carro, una casa, una persona, etc., continuamente están emitiendo ondas electromagnéticas.

Para entender por qué sucede, considera lo siguiente:
- Los objetos están hechos de átomos.
- Un átomo puede emitir radiación cuando uno de sus electrones pierde energía, pasando a un orbital de menor energía.
- Un átomo puede absorber radiación cuando uno de sus electrones gana energía y, en consecuencia, pasa a un orbital de mayor energía.
- El movimiento de los átomos en un objeto produce choques o vibraciones que estimulan la emisión y absorción de radiación.
- Un aumento en la temperatura de un objeto representa un aumento de la energía cinética, de movimiento, de sus átomos.
- En la naturaleza ningún objeto puede tener temperatura absoluta igual a cero.
En conclusión, todos los cuerpos emiten radiación electromagnética por el hecho de estar a una temperatura distinta de cero.
Considerando lo anterior, Max Plank, descubrió que la intensidad de radiación para cada longitud de onda depende únicamente de la temperatura del cuerpo en cuestión.En la siguiente animación se presenta la ley de Planck, la cual describe la radiación electromagnética emitida por un cuerpo negro en equilibrio térmico a una temperatura absoluta dada (en K). Observa que la radiación emitida depende de la temperatura absoluta (en kelvin), para cada temperatura hay un espectro de radiación en diversas longitudes de onda. En el "peak" de la figura se produce la radiación máxima.
El descubrimiento de este fenómeno tuvo su historia:
A finales del siglo XIX era un problema crucial en la Física explicar la radiación emitida por un cuerpo negro. Se sabía, en definitiva, que la intensidad de dicha radiación aumenta con la longitud de onda hasta un valor máximo y, a continuación, disminuye al aumentar la longitud de onda.
- En general, un cuerpo que recibe radiación puede absorberla, reflejarla y emitirla. Gustav Kirchhoff en 1862 definió un cuerpo negro como aquel que es un absorbente ideal y por lo tanto también un emisor ideal.
- Un cuerpo negro se puede modelar por una cavidad con una pequeña abertura. La energía radiante incidente a través de la abertura, es absorbida por las paredes en múltiples reflexiones y solamente una mínima proporción escapa (se refleja) a través de la abertura. Podemos suponer que toda la energía incidente es absorbida.
-


El efecto fotoeléctrico
 La explicación teórica del efecto
fotoeléctrico fue hecha por Albert
Einstein, teniendo como base los cuantos propuestos por
Max Planck. Robert Andrews Millikan pasó diez años
experimentando para demostrar que la teoría de Einstein no
era correcta, para finalmente concluir que sí lo era.
Einstein y Millikan obtuvieron el premio Nobel en 1921 y
1923, respectivamente.
La explicación teórica del efecto
fotoeléctrico fue hecha por Albert
Einstein, teniendo como base los cuantos propuestos por
Max Planck. Robert Andrews Millikan pasó diez años
experimentando para demostrar que la teoría de Einstein no
era correcta, para finalmente concluir que sí lo era.
Einstein y Millikan obtuvieron el premio Nobel en 1921 y
1923, respectivamente.
Un fenómeno que no se podía explicar, en el marco de la física clásica, fue el siguiente:
Cuando se hace incidir radiación electromagnética sobre ciertos metales, se observa que éstos despiden electrones. Estamos hablando del efecto fotoeléctrico. El descubrimiento de este fenómeno tuvo su historia:
El descubrimiento de este fenómeno tuvo su historia:
- El primer informe sobre este fenómeno lo hizo E. Becquerel en 1893. Al iluminar una placa de una pareja metálica que se encontraba en una solución, se dio cuenta de que se modificaba el voltaje entre ellas.
- Posteriormente Hertz y W. Hallwachs encontraron que una placa metálica con carga eléctrica negativa podía perder su carga al ser iluminada con radiación ultravioleta.
- Fue Philipp Lenard quien, en 1902, demostró que estos fenómenos se debían a la expulsión de electrones del metal bajo el estímulo de la radiación. Resulta que los metales eran más sensibles bajo la acción de la radiación ultravioleta que bajo la acción de luz visible.
En particular, se encontró que por muy alta que fuera la intensidad de la radiación, si la frecuencia de la onda incidente es pequeña, no se despiden electrones. No hay emisión a menos que la frecuencia de la radiación tenga un valor mayor a un valor definido, llamado frecuencia umbral. El valor de la frecuencia umbral es distinto para metales diferentes.
La teoría electromagnética de Maxwell no pude explicar el efecto fotoeléctrico. Modelo de atómico de Bohr
Modelo de atómico de Bohr Anteriormente vimos que el modelo de Rutherford
tenía varios problemas. En 1913 Niels
Bohr resuelve el problema argumentando
que la teoría clásica no es válida en el interior
del átomo. Aprovecha la teoría de Planck del cuerpo negro
y la cuantificación de fotones de Enstein (efecto
fotoeléctrico) e introduce tres
postulados, que son la base de su modelo.
Anteriormente vimos que el modelo de Rutherford
tenía varios problemas. En 1913 Niels
Bohr resuelve el problema argumentando
que la teoría clásica no es válida en el interior
del átomo. Aprovecha la teoría de Planck del cuerpo negro
y la cuantificación de fotones de Enstein (efecto
fotoeléctrico) e introduce tres
postulados, que son la base de su modelo.
Un gran exito es la solución del problema de las líneas espectrales del hidrógeno.Postulado 1
El electrón gira alrededor del núcleo en un conjunto fijo de órbitas permitidas, denominadas estados estacionarios. A cada una le corresponde una energía, en ellas el electrón gira sin absorber ni emitir energía. Postulado 2
Postulado 2
No todas las órbitas son posibles. Sólo estan permitidas aquellas órbitas cuyo radio cumpla que el momento angular sea múltiplo entero de h/2∏.
Las órbitas a las que le correspondería valores no enteros del número cuántico principal, no existen.
 Éxitos y problemas del modelo
Éxitos y problemas del modelo
A favor:
- Justifica la estabilidad del átomo.
- Introduce el concepto de niveles de energía que explica cualitativa y cuantitativamente el espectro del átomo de hidrógeno y cualitativamente el de los demás.
- Relaciona propiedades químicas de los átomos con su estructura atómica.
En contra:
- Mezcla arbitrariamente conceptos de la física clásica con otros incompatibles con ellos (órbitas cuantizadas y estacionarias, ley de Planck de la radiación)
- Explica cuantitativamente bien los espectros del hidrógeno pero no los de los átomos polielectrónicos.
- Supone que los electrones "orbitan" en torno al núcleo en órbitas circulares, lo cual no es adecuado, ya que al aplicar un campo magnético se observan distintos comportamientos dentro de un mismo subnivel.
Dualidad onda-partícula

Bohr postuló la existencia de las órbitas estables, debido a que no pudo proporcionar alguna razón para explicarlas, ni tampoco la condición de selección de las mismas.
Fue Louis De Broglie, quién justificó la relación encontrada por Bohr para la selección de las órbitas estables; introduciendo la naturaleza ondulatoria de los electrones.En 1924, en su tesis doctoral, De Broglie propuso la existencia de ondas de materia. Él sugirió que si una onda electromagnética (como la luz) tenía propiedades de partícula (corpusculares), entonces una partícula en movimiento debería tener propiedades ondulatorias.
La longitud de onda λde la onda asociada a la materia es:
λ=hp=hmvDonde h
es la constante de Planck y p el momento del electrón.
Justificación del segundo Postulado de Bhor
La suposición de que el momento angular está cuantizado no resulta tan fácil de interpretar; sin embargo si se combina la hipótesis de De Broglie, en donde el electrón tiene asociada una longitud de onda (?=h/mv), se encuentra que las órbitas estables son aquellas en las que caben exactamente un número entero de longitudes de onda. Son las que satisfacen la siguiente condición:
En 1924, en su tesis doctoral, De Broglie propuso la existencia de ondas de materia. Él sugirió que si una onda electromagnética (como la luz) tenía propiedades de partícula (corpusculares), entonces una partícula en movimiento debería tener propiedades ondulatorias.Pero, la hipótesis de De Broglie es simplemente eso, una suposición. ¿Cómo comprobar si es cierta?
Una forma es la siguiente:
Las ondas tienen propiedades de onda: interferencia, difracción, etc. Por lo tanto, para demostrar que "algo" no es una partícula, basta mostrar que tiene propiedades de onda. Por ejemplo, si ese "algo" sufre difracción es que es una onda y no una partícula.
Sólo tres años después de la propuesta de De Broglie, G.P. Thomson, en Inglaterra, y C.G. Davisson y L. Germer, en Estados Unidos, de forma independiente confirmaron la existencia de las ondas de De Broglie. Comprobaron la difracción de electrones por redes cristalinas.
Difracción de electrones mediante doble rendija
Modelo atómico cuántico
Bohr propuso su modelo, en el que los electrones girarían en órbitas circulares de energía cuantizada. Funcionaba muy bien para el átomo de hidrógeno, pero en los espectros realizados para otros átomos se observaba que los electrones de un mismo nivel energético tenían distinta energía.
Algo andaba mal. La conclusión fue que dentro de un mismo nivel energético existían subniveles.
Sommerfeld hizo algunos cambios, y sugirió:- El principio de incertidumbre de Heisenberg (1927), el cual establece la imposibilidad de determinar simultáneamente y con precisión la posición y el momento lineal de una partícula en un momento dado. Ya no se podría decir dónde se encontraría con exactitud una partícula, como máximo se podría llegar a precisar el punto en dónde se hallaría con mayor probabilidad.
- La dualidad onda-partícula propuesta por Louis de Broglie en 1924. Él postula que el electrón y toda partícula material en movimiento tienen un comportamiento ondulatorio.
En otras palabras: que podría haber órbitas elípticas con niveles de energía diferentes.
Esto dio lugar a un nuevo número cuántico: "El número cuántico azimutal o secundario", que determina la forma de los orbitales, se lo representa con la letra "l" y toma valores que van desde 0 hasta n-1
 Sin embargo el avance de la mecánica cuántica introdujo nuevos elementos que modificaron la visión del átomo, en particular:
Sin embargo el avance de la mecánica cuántica introdujo nuevos elementos que modificaron la visión del átomo, en particular:
- El principio de incertidumbre de Heisenberg (1927), el cual establece la imposibilidad de determinar simultáneamente y con precisión la posición y el momento lineal de una partícula en un momento dado. Ya no se podría decir dónde se encontraría con exactitud una partícula, como máximo se podría llegar a precisar el punto en dónde se hallaría con mayor probabilidad.
- La dualidad onda-partícula propuesta por Louis de Broglie en 1924. Él postula que el electrón y toda partícula material en movimiento tienen un comportamiento ondulatorio.
Schrödinger en 1926 propusó que los electrones no giran en órbitas, sino que se les asigna unas zonas del espacio en las que la probabilidad de encontrarlos es máxima, llamadas orbitales. En los libros se representan los núcleos atómicos rodeados por orbitales electrónicos con forma de esfera difusa, o de mancuerna, o de trípode, etc. Pero como ya dijimos, esas figuras representan la probabilidad de encontrar un electrón en tal o cual lugar en torno al núcleo más que una “forma”Schrödinger en 1926 propusó que los electrones no giran en órbitas, sino que se les asigna unas zonas del espacio en las que la probabilidad de encontrarlos es máxima, llamadas orbitales. En los libros se representan los núcleos atómicos rodeados por orbitales electrónicos con forma de esfera difusa, o de mancuerna, o de trípode, etc. Pero como ya dijimos, esas figuras representan la probabilidad de encontrar un electrón en tal o cual lugar en torno al núcleo más que una “forma”

En otras palabras los orbitales son funciones matemáticas, que indican una zona del espacio donde es probable encontrar un electrón.
Por ejemplo, en el caso del orbital esférico (orbital s) se indica que hay una cierta probabilidad de encontrar electrones en la zona del espacio contenida dentro de esa esfera.
¿Es imposible encontrar electrones fuera de esa zona? No, es posible, pero improbable.Historia de los modelos atómicos.

-
-
Núcleo atómico
La materia está compuesta por moléculas, que son agrupaciones de átomos. Dichos átomos constan de un núcleo (con protones y neutrones) y una corteza electrónica. Las características básicas del núcleo son:
- El núcleo atómico contiene en principio dos tipos de partículas: los nucleones (protones y neutrones), de aproximadamente la misma masa. El protón presenta carga +e, igual la carga del electrón con signo contrario, y el neutrón que no tiene carga neta.
- El número atómico (Z) de un elemento es el número de protones que tiene cualquier atómo de ese elemento.
- El número total de nucleones o número másico de un elemento (A=N+Z), es igual al número de protones más el de neutrones.

Partículas subatómicas del átomo
Partícula Símbolo Carga Eléctrica (C) Masa (kg) uma Electrón e− 1.6×10−19 9.11×10−31 5.49×10−4 Protón p+ 1.6×10−19 1.673×10−27 1.0073 Neutrón n 0 1.675×10−27 1.0086 *La unidad de masa atómica se define como la doceava parte (1/12) de la masa del carbono-12.
Isótopos
El número de neutrones que acompañan a los protones en un núcleo puede variar dentro de un pequeño rango. Ésta variabilidad da lugar a los isótopos, átomos con el mismo número atómico (igual número de protones) pero de distinto número másico (distinto número de neutrones).Todos los isótopos de un elemento presentan las mismas propiedades químicas, ya que éstas dependen del número de electrones. Por el contrario, tienen diferencias en algunas propiedades físicas, como por ejemplo, la masa, o la capacidad de desintegrarse radiactivamente.
Radioactividad
En 1896 el físico francés Henry Becquerel descubrió la radioactividad natural, que consiste en el proceso mediante el cual los nucleidos emiten espontáneamente diferentes formas de radiación. También Marie y Pierre Curie, en 1898, descubrieron nuevas sustancias que producían este efecto: el Polonio y el Radio. Posteriormente se han ido descubriendo más, hasta aproximadamente. 1300 nucleidos radiactivos conocidos actualmente. El decaimiento radiactivo de un núcleo atómico es un proceso espontáneo de desintegración de dicho núcleo.El resultado es la emisión de radiación ya sea electromagnética o corpuscular y la aparición de un nuevo núcleo, así como la liberación de la correspondiente energía de decaimiento. Se conocen basicamente tres tipos de radioactividad natural, representadas por Núcleos de Helio( α), electrones ( β) y Ondas electromagnéticas (γ).

En 1913 los científicos Soddy y Fajans propusieron una regla que gobierna la transmutación de los elementos durante la desintegración radiactiva:
- Cuando un átomo radiactivo emite una partícula α, se crea un elemento cuyo número atómico disminuye en 2 unidades y cuyo número másico disminuye en 4 unidades respecto a las del radioisótopo padre.

- Cuando un núcleo emite una partícula beta β−, el número másico se mantiene sin cambios, mientras que el número atómico aumenta en 1 unidad

- La desintegración β+(por emisión de positrones) y la captura de electrones, se obsevó que el número atómico disminuye en 1 unidad respecto a la del radioisótopo padre. (fue descubierta más adelante)
- Cuando un núcleo emite radiación γ, continúa siendo del mismo elemento químico.
Ley de desintegración radiactiva
-
-